正常細胞的使用壽命最高,最終死亡。在這些細胞中。由於抑制人端粒酶轉錄酶(HOT),因此無法合成染色體的末端,這導致端粒較短。
儘管連接尚不清楚,但許多研究表明,HORT的新激活導致端粒維持,這可能導致癌症。同時,它表明兩種蛋白質與端粒與g四鏈體相互作用
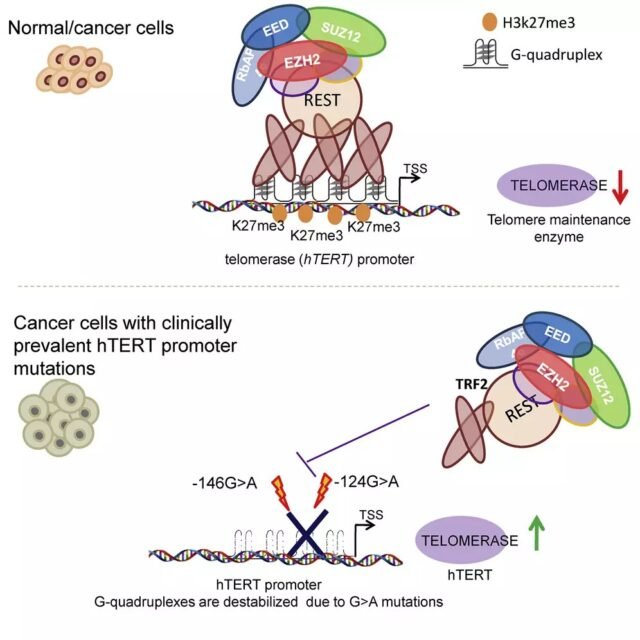
因為在最新研究中,HOTT啟動子多次具有G-Quadrupplex的序列。科學家們已經檢查了端粒重複結合因子2(TRF2)是否與發起人有關HETT控制,在端粒和端粒酶之間產生分子,這對於層次,年齡和改革治療的變化可能很重要。 細胞報告–
科學家在脊柱中指定tert啟動子,用於G Quadrupplex。同時,由於TRF2是具有真正的端粒PCR結合的蛋白質,因此將端粒PCR用作TRF2芯片的陽性對照。免疫,實時PCR,印跡,ELISA分析
Chowdhury及其同事教授表明,TRF2與Hott啟動子直接相互作用,並控制癌症和正常細胞中的Hott和端粒酶活性。他們還發現,MYB和TRF2的主要域對於控制霍特的去除都是必要的。 TRF2控制Hott染色質的靜態狀態; TRF2的招聘PolyComb招募複合物(PRC2)
該團隊發現與Hott Manager的TRF2連接不取決於端粒,但取決於G-Quadrupplex。在癌症中,霍特的啟動子的突變將消失,並且通過G Qu-Quadrupplex穩定性,TRF2是結合的和端粒。
他們的發現將有助於了解與端粒和端粒酶有關的衰老,癌症,細胞衰老以及DNA損傷反應的更多信息。 Chowdhury教授說:“癌症中的Telomers案特別重要,儘管必須進行其他測試來測試我們的Crosstk。
他還補充說:“長時間的端粒酶和端粒對於維持加人的維持/生存至關重要”。因此,與端粒相關的HOTT法規在多能中可能很重要。
這項研究表明,第一次抑製膠質母細胞瘤多時間和其他癌症和其他癌症引起的其他癌症的霍特通過使用小分子,從而提供了可能發生的治療機會。小分子適合結合和穩定性。這些結果為分子帶來了有趣的機會。 g-四鏈體曲線用於膠質母細胞瘤多形膠質母細胞瘤的干預 – 破壞性腦癌。
Chowdhory說:“這些結果共同引入端粒和端粒酶之間的分子,這對於發展對知識知識的理解可能很重要,包括腫瘤,年齡和差異/差異的變化。”

期刊參考:
Sharma S,Mukherje AK,Roy SS,Bagri S,Lier S,Verma M,Sengupta A,Kumar M,Nesse G,Pandy DP,Chowdhury S. Telomerase。人類通過相互作用直接控制。 TRF2-GGG- Quadpruplex細胞代理2021年5月18日; 35(7):109154 doi:10.1016/j.clrep.2021.109154 PMID:34010660
關於作者

Shalu Sharma博士博士
在2014年獲得微生物學碩士學位後,Cha Luchar博士與Csir Gigib的Chan Nu Nu博士一起工作,從事博士學位SC Lab研究癌症,重點是生物學。 Telomere,她首先探討了Telomers關於手機老年時代的規則以及整個基因組中基因組的去除。她逐漸關注理解人類規則。端粒酶在癌症中的啟用過多>研究團隊的最新發現的90%,它揭示了端粒最終如何指示如何控制端粒酶啟動子的端粒酶診所,從而導致端粒酶用戶。由此,團隊發現了與DNA結合進行干預的小分子的潛力。

Ananda K Mukherje博士– 博士學位
Ananda K Mukherje博士於2014年在IGIB的Shantanu Chowdhury博士擔任研究生,並被介紹給Telomere Biology和Telomere Bindomering Protein-TRF2。在那之後,他們觀察到TRF2將通過使用通過治療組蛋白直接抑制端粒酶。牛仔褲啟動子上的g四鏈體也發現特定的G Quadpplex會干擾突變。 Glaioblastoma導致該規則的喪失。如今,他正試圖了解癌細胞長度的多樣性如何影響免疫對癌症的反應。

Shantanu Chowdhury教授博士
Shantanu Chowdhury目前是教授。新德里的CSIR基因組學和綜合生物學的研究興趣包括了解一種稱為G- Quqadruplexes的非翻譯結構的功能。尤其是在2002年控制端粒酶和端粒癌症功能時。 (印度最著名的科學獎)他是DBT / Wellcome Trust India Alliance的高級朋友,並且是生物化學品編輯的成員。
主要圖片來源:Chowdhury等人 https://doi.org/10.1016/j.celrep.2021.109154