導管腺癌(PDAC)是癌症階段的強大對手,這是由於隱藏的進步和嚴重的後果而聞名的。它處於與世界各地癌症有關的死亡之巔,在接下來的十年中,預計將增加PDAC死亡的主要原因是侵略性的性質,這是胰腺的深度解剖結構,在高級距離處經常診斷,並且有限的肩部聲譽。這種不良情況加強了對科學界緊急行動的需求,以破譯分子的奧秘,這些分子通過為介入創新和有效治療的干預而推動了PDAC的不兼容。
PDAC以積極進取和具有挑戰性的景觀而聞名,他可能會面對與癌症鬥爭的新競爭者,Upender Manne教授及其在伯明翰阿拉巴馬大學的同事,與華盛頓大學的研究人員合作,在聖路易斯和科技Rorosary大學的研究人員合作,發表 瘤– 新的Trip13治療靶標的結果,該蛋白在PDAC腫瘤中表達,在腫瘤的生長,擴散和醫療耐藥性中起重要作用。
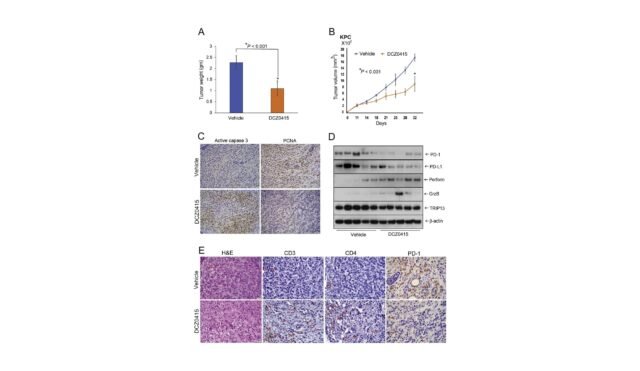
研究的創新方法著重於TRIP13的遺傳衰落和使用小分子DCZ0415 Manne教授及其同事對TRIP13的抑制產生巨大影響,以增加PDAC細胞的數量。與癌症有關的重要信號傳輸路線
這種非凡的教育的基礎是各種強大的框架。最初,研究小組試圖了解Trip13在PDAC上的作用。他們發現Trip13充當PDAC的增長支持者和擴散。尤其是具有DCZ0415抑製劑的Trip13目標,無論是唯一的抑製劑,並且還保持標準標準,從而有助於具有高TRIP13表達的PDAC的進展。
在通過PDAC細胞行為的範圍來調查該作用的過程中,該團隊通過顯示多種遺傳背景來使用各種人類PDAC細胞電纜。曼恩教授解釋說:“我們提供了顯示突變狀態的人類PDAC細胞。這些細胞在我們的全面分析中很有用。”
研究的重要一點是評估PDAC細胞通過傷口治療的遷移潛力。這種方法不僅是澄清抑制Trip13對細胞遷移的影響,還提供了抑制“ shRNA,TRIV13-SILENCE和受控的細胞以及已通過DCZ0415處理的細胞的抑制效率的具體測量值,以檢查對這一遷移的影響,從而使我們對Trip的影響進行了治療,以評估Trip 13的範圍。馬恩。
這些發現的含義是一個深刻的問題,它提供了一個由Biomerker驅動的臨床實驗,並提供了通過設定Target Trip13來改善PDAC治療策略的希望,不僅是在匯詞中為更有效的治療鋪平了道路,Manne教授及其團隊的創新研究在與PDAC鬥爭中取得了進步,在PDAC上扮演了精緻的角色,並專注於Trip13。在PDAC的運作中,這項研究開放了一個新的干預渠道,導致患者面臨這一具有挑戰性的診斷。
參考期刊
Farrukh Afaq,Sumit Agarwal,Prachi Bajpai等。
山: https://doi.org/10.1016/j.neo.2023.100951–
作曲家
Mis。 曼恩博士是伯明翰(UAB)阿拉巴馬大學外科和流行病學教授。他還是病理學,翻譯的主任,該病理學是生物組織的合夥人,高級科學家奧尼爾的高級癌症中心,狂熱的研究中心,健康科學中心和健康中心。大約三十年前,曼恩教授一直是美國國家衛生研究院/美國國家癌症研究所(NCI)的R,P和U系列。他已廣泛發表在發現生物群落,癌症分子以及檢查許多癌症健康的準確性和不平等中。他從患者進行了許多臨床前癌症模型(異種移植和器官模型)進行測試。 Manne教授教育的其他方面是培訓學生和科學家進行癌症研究並進行有效的教育。